ETHINYLESTRADIOL DROSPIRENONE
Les gammes de produits
DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Non remboursé
Sur prescription seulement
Forme :
Comprimé pelliculé
Catégories :
Contraception et interruption de grossesse, Contraception hormonale, Estroprogestatifs combinés, Minidosés : = < 0,04 mg d'éthinylestradiol, Monophasiques, Ethinylestradiol + Drospirénone
Principes actifs :
Comprimé actif (rose) :, Ethinylestradiol, Drospirénone
Posologie pour DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Indications
Contraception orale
Posologie
Adulte - Enfant de plus de 12 ans . de sexe féminin en âge de procréer. Contraception orale (implicite)
1 comprimé par jour au même moment de la journée.
A prendre régulièrement et sans oubli.
Administration
Voie orale
Recommandations patient
ARRETER le traitement et CONSULTER immédiatement un médecin en cas de :
- Gonflement d'une jambe ou le long d'une veine de la jambe ou du pied, en particulier s'il s'accompagne de douleur ou sensibilité, chaleur, changement de couleur de la peau.
- Difficultés à respirer, essoufflement soudain.
- Toux inhabituelle, de survenue brutale, sans cause évidente avec parfois des crachats de sang.
- Douleur aiguë dans la poitrine pouvant s'accentuer en cas de respiration profonde, gêne, pression, lourdeur, irradiant ou non vers le dos, la mâchoire, la gorge, le bras, l'estomac.
- Etourdissements ou sensations vertigineuses sévères.
- Battements de coeur rapides ou irréguliers.
- Douleur intense dans l'estomac.
- Trouble de la vue, cécité partielle ou totale, ou vision double.
- Sensation d'oppression ou d'encombrement dans la poitrine, le bras ou sous le sternum.
- Faiblesse, sensation bizarre ou engourdissement très important affectant une partie du corps.
- Trouble du langage ou incapacité à parler ou à comprendre.
- Apparition soudaine de difficultés à marcher, de sensations vertigineuses, d'une perte d'équilibre ou de coordination.
- Maux de têtes sévères, prolongés et inhabituels ou crises de migraine plus fréquentes ou plus intenses que d'habitude.
- Perte de conscience ou évanouissement avec ou sans crise convulsive.
CONSULTER le médecin en cas de spottings persistant plus de 7 jours ou si les saignements sont abondants.
CONTACTER
LE MEDECIN DES QUE POSSIBLE en cas de changements d'humeur et de
symptômes dépressifs, y compris peu de temps après le début du
traitement.
EVITER :
- L'exposition au soleil ou aux UV en cas de mélasme/chloasma apparu lors d'une grossesse ou sous contraceptifs oraux estroprogestatifs.
- La prise de millepertuis (Hypericum perforatum) pendant le traitement (possibilité de diminuer l'efficacité contraceptive du médicament).
Contre-indications pour DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
- Thrombose
- Risque thrombo-embolique veineux
- Antécédent de thrombose
- Prédisposition à la thrombose
- Intervention chirurgicale majeure
- Immobilisation prolongée
- Traumatisme majeur
- Prodrome de thrombose artérielle
- Maladie cérébrovasculaire
- AVC
- Antécédent d'AVC
- Antécédent de migraine avec signes neurologiques focalisés
- Diabète avec complication vasculaire
- Hypertension artérielle sévère
- Dyslipoprotéinémie sévère
- Affection hépatique sévère
- Antécédent d'affection hépatique sévère en l'absence de normalisation des tests fonctionnels hépatiques
- Insuffisance rénale sévère
- Insuffisance rénale aiguë
- Tumeur hépatique évolutive
- Tumeur hépatique ancienne
- Tumeur hormonodépendante (de la femme)
- Saignement vaginal d'origine inconnue
- Sujet de sexe masculin
- Fille prépubère
- Femme ménopausée
- Intolérance au lactose
- Grossesse
- Allaitement
Effets indésirables pour DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Niveau d’apparition des effets indésirables
Peu fréquent
Alopécie
Aménorrhée
Asthénie
Cancer du sein
Candidose vaginale
Constipation
Crampe musculaire
Cystite
Diarrhée
Douleur
Eczéma
Extrasystole
Galactorrhée
Gastro-entérite
Hypertension
Hypotension
Ménorragie
Migraine
Nervosité
Oedème
Pharyngite
Tachycardie
Troubles menstruels
Vaginite
Varice
Vertige
Dépression
Douleur pelvienne
Hypersudation
Candidose
Paresthésie
Perte de poids
Séborrhée
Sécheresse vaginale
Trouble cutané
Bouffées de chaleur
Diminution de la libido
Augmentation de l'appétit
Peau sèche
Réaction allergique
Nausée
Vomissement
Kyste ovarien
Prurit cutané
Trouble du sommeil
Troubles gastro-intestinaux
Vision anormale
Maladie fibrokystique du sein
Rash cutané
Herpes simplex
Troubles vulvovaginaux
Douleur aux extrémités
Douleur du cou
Angioedème
Soif excessive
Frottis cervical douteux
Décharge vaginale
Rare
Asthme
Thrombo-embolie veineuse
Erythème polymorphe
Hypoacousie
Erythème noueux
Thrombo-embolie artérielle
Inconnu
Chloasma
Epilepsie
Fibrome utérin
Infarctus du myocarde
Lupus érythémateux disséminé
Maladie de Crohn
Porphyrie
Tumeur hépatique
Embolie pulmonaire
Spotting
Aggravation d'épilepsie
Ictère cholestatique
Colite hémorragique
Aggravation d'un lupus érythémateux disséminé
Accident ischémique transitoire
Aggravation d'une porphyrie
Syndrome urémique hémolytique
Chorée de Sydenham
Herpès gravidique
Aggravation de fibrome utérin
Migraine aggravée
Aggravation de maladie de Crohn
Perturbation de la fonction hépatique
Aggravation d'angioedème
Exacerbation d'une chorée de Sydenham
Aggravation d'herpès gravidique
Aggravation d'un syndrome urémique hémolytique
Aggravation d'ictère cholestatique
Consulter également la rubrique Mises en garde et précautions d'emploi concernant les effets indésirables graves chez les utilisatrices de CHC.
Les effets indésirables suivants ont été rapportés au cours de l'utilisation de l'association drospirénone et éthinylestradiol.
Sur la base des essais cliniques, le tableau ci-dessous décrit par fréquence les effets indésirables selon la classification système-organe MedDRA.
Le terme MedDRA le plus approprié est utilisé afin de décrire un certain type de réaction ainsi que ses synonymes et pathologies liées.
Description de certains effets indésirables particuliers
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l'infarctus du myocarde, l'AVC, les accidents ischémiques transitoires, la thrombose veineuse et l'embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détails en rubrique Mises en garde et précautions d'emploi.
Les effets indésirables graves suivants observés chez des femmes utilisatrices de contraceptifs oraux combinés sont également décrits à la rubrique Mises en garde et précautions d'emploi.:
· accidents thromboemboliques veineux ;
· accidents thromboemboliques artériels ;
· hypertension ;
· tumeurs hépatiques ;
· survenue ou aggravation d'affections dont l'association avec les contraceptifs oraux n'est pas certaine: maladie de Crohn, colite hémorragique, épilepsie, fibrome utérin, porphyrie, lupus érythémateux disséminé, herpès gravidique, chorée de Sydenham, syndrome urémique hémolytique, ictère cholestatique ;
· chloasma ;
· perturbations chroniques ou sévères de la fonction hépatique pouvant nécessiter l'arrêt de la contraception orale jusqu'à normalisation des tests de la fonction hépatique ;
· survenue ou aggravation des symptômes d'angioedème par les estrogènes exogènes chez les femmes présentant un angioedème héréditaire.
La fréquence de diagnostic de cancer du sein est très légèrement augmentée chez les utilisatrices de contraceptifs oraux combinés. Comme le cancer du sein est rare chez les femmes de moins de 40 ans, cette augmentation est faible par rapport au risque général de cancer du sein. La relation de causalité avec l'utilisation d'un contraceptif oral reste inconnue. Pour plus d'information se reporter aux rubriques Contre-indications et Mises en garde et précautions d'emploi.Interactions
Des métrorragies et / ou un échec de la contraception peut résulter d'interactions d'autres médicaments (inducteurs enzymatiques) avec les contraceptifs oraux (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : signalement.social-sante.gouv.fr.
Voir plus
Grossesse et allaitement pour le DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Grossesse
DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU n'est pas indiqué pendant la grossesse.
En cas de découverte d'une grossesse sous DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU, son utilisation devra être immédiatement interrompue.
De nombreuses études épidémiologiques n'ont pas révélé de risque augmenté d'anomalies congénitales chez les enfants nés de femmes ayant utilisé un contraceptif oral avant la grossesse. Aucun effet tératogène n'a été observé si un contraceptif a été pris par erreur au cours de la grossesse.
Des études chez l'animal ont montré la présence d'effets indésirables au cours de la grossesse et de l'allaitement (voir rubrique Données de sécurité précliniques). D'après ces données, un effet indésirable dû à l'activité hormonale des principes actifs ne peut être exclu. Cependant, sur la base de l'expérience de l'utilisation des contraceptifs oraux combinés pendant la grossesse, un tel effet indésirable n'a pas été observé chez l'homme.
Les données disponibles concernant l'utilisation de l'association drospirénone et éthinylestradiol au cours de la grossesse sont trop peu nombreuses pour permettre de conclure à d'éventuels effets néfastes de DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU sur la grossesse ou sur la santé du foetus ou du nouveau-né. Aucune donnée épidémiologique ne permet à ce jour de conclure.
L'augmentation du risque de TEV en période post-partum doit être prise en compte lors de la reprise de DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU (voir rubriques Posologie et mode d'administration et Mises en garde et précautions d'emploi).
Allaitement
Les contraceptifs oraux combinés pouvant influer sur la composition quantitative et qualitative du lait maternel, ceux-ci sont généralement déconseillés jusqu'à la fin du sevrage. L'utilisation de contraceptifs oraux combinés peut s'accompagner d'une excrétion de faibles quantités de ces contraceptifs et/ou de leurs métabolites lites dans le lait pouvant avoir un effet chez l'enfant.
Mise en garde pour DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Mise en garde
Mises en garde spéciales :
Si la patiente présente l'un des troubles ou l'un des facteurs de risque mentionnés ci-dessous, la pertinence du traitement par DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU doit être discutée avec elle.
En cas d'aggravation ou de survenue de l'un de ces troubles ou facteurs de risque, la nécessité d'interrompre l'utilisation de DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU doit être discutée entre le médecin et la patiente.
En cas de survenue ou de suspicion de TEV ou de TEA, la contraception orale combinée doit être interrompue. Si un traitement anti-coagulant est initié, une autre méthode contraceptive appropriée doit être instaurée, en raison du potentiel tératogène du traitement anti-coagulant (dérivés coumariniques).
Troubles circulatoires
· Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n'en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels que DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU, peut être jusqu'à deux fois plus élevé. La décision d'utiliser tout autre CHC que ceux associés au risque de TEV le plus faible doit être prise uniquement après concertation avec la patiente afin de s'assurer qu'elle comprend le risque de TEV associé à DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU, l'influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d'utilisation. Certaines données indiquent également une augmentation du risque lors de la reprise d'un CHC après une interruption de 4 semaines ou plus.
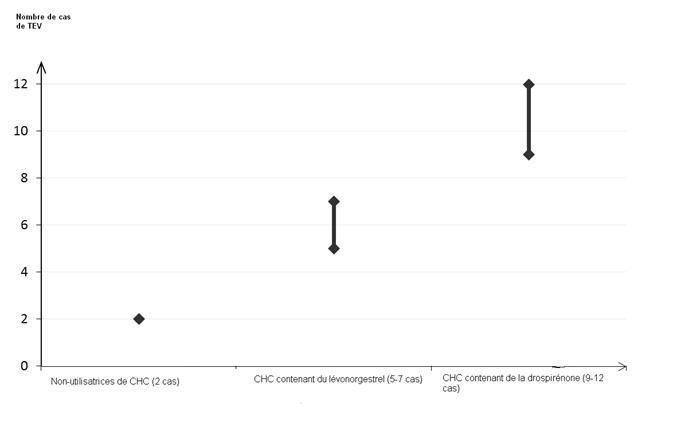
Parmi les femmes qui n'utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d'un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu'elle présente (voir ci-dessous).
On estime1 que sur 10 000 femmes qui utilisent un CHC contenant de la drospirénone, 9 à 12 développeront une TEV sur une période d'un an ; ce nombre est à comparer à celui d'environ 62 chez les femmes qui utilisent un CHC contenant du lévonorgestrel.
Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
1 Ces incidences ont été estimées à partir de l'ensemble des données des études épidémiologiques, en s'appuyant sur les risques relatifs liés aux différents CHC en comparaison aux CHC contenant du lévonorgestrel.
2 Point central de l'intervalle de 5-7 pour 10 000 années-femmes sur la base d'un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d'un CHC, d'environ 2,3 à 3,6
Nombre de cas de TEV pour 10 000 femmes sur une période d'un an
De façon extrêmement rare, des cas de thrombose ont été signalés chez des utilisatrices de CHC dans d'autres vaisseaux sanguins, p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d'autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique Contre-indications). Lorsqu'une femme présente plus d'un facteur de risque, il est possible que l'augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement - dans ce cas, le risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique Contre-indications).
Tableau : Facteurs de risque de TEV
| Facteur de risque | Commentaire |
| Obésité (indice de masse corporelle supérieur à 30 kg/m²) | L'élévation de l'IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte si d'autres facteurs de risque sont présents. |
| Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur Remarque : l'immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d'autres facteurs de risque | Dans ces situations, il est conseillé de suspendre l'utilisation de la pilule (au moins quatre semaines à l'avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d'éviter une grossesse non désirée. Un traitement anti-thrombotique devra être envisagé si DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU n'a pas été interrompu à l'avance. |
| Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) | En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation de CHC |
| Autres affections médicales associées à la TEV | Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose |
| Âge | En particulier au-delà de 35 ans |
Il n'existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l'apparition ou la progression d'une thrombose veineuse.
L'augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Grossesse et allaitement », voir rubrique Fertilité, grossesse et allaitement).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu'en cas d'apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu'elles utilisent un CHC. Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
· gonflement unilatéral d'une jambe et/ou d'un pied ou le long d'une veine de la jambe ;
· douleur ou sensibilité dans une jambe, pouvant n'être ressentie qu'en position debout ou lors de la marche ;
· sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l'embolie pulmonaire (EP) peuvent inclure :
· apparition soudaine et inexpliquée d'un essoufflement ou d'une accélération de la respiration ;
· toux soudaine, pouvant être associée à une hémoptysie ;
· douleur thoracique aiguë ;
· étourdissements ou sensations vertigineuses sévères ;
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d'événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Les autres signes d'une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d'une extrémité.
Si l'occlusion se produit dans l'oeil, les symptômes peuvent débuter sous la forme d'une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
· Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l'utilisation de CHC et l'augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d'accident cérébrovasculaire (p. ex. accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d'accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau).
DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique Contre-indications). Lorsqu'une femme présente plus d'un facteur de risque, il est possible que l'augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement - dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique Contre-indications).
Tableau : Facteurs de risque de TEA
| Facteur de risque | Commentaire |
| Âge | En particulier au-delà de 35 ans |
| Tabagisme | Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d'utiliser une méthode de contraception différente. |
| Hypertension artérielle | |
| Obésité (indice de masse corporelle supérieur à 30 kg/m2) | L'élévation de l'IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte chez les femmes présentant d'autres facteurs de risque. |
| Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) | En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation de CHC. |
| Migraine | L'accroissement de la fréquence ou de la sévérité des migraines lors de l'utilisation d'un CHC (qui peut être le prodrome d'un événement cérébrovasculaire) peut constituer un motif d'arrêt immédiat du CHC. |
| Autres affections médicales associées à des événements indésirables vasculaires | Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé |
Symptômes de TEA
Les femmes doivent être informées qu'en cas d'apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu'elles utilisent un CHC.
Les symptômes d'un accident cérébrovasculaire peuvent inclure :
· apparition soudaine d'un engourdissement ou d'une faiblesse du visage, d'un bras ou d'une jambe, en particulier d'un côté du corps ;
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d'une perte d'équilibre ou de coordination ;
· apparition soudaine d'une confusion, de difficultés à parler ou à comprendre ;
· apparition soudaine de difficultés à voir d'un oeil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de conscience ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu'il s'agit d'un accident ischémique transitoire (AIT).
Les symptômes de l'infarctus du myocarde (IM) peuvent inclure :
· douleur, gêne, pression, lourdeur, sensation d'oppression ou d'encombrement dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l'estomac ;
· sensation d'encombrement, d'indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou sensations vertigineuses;
· faiblesse, anxiété ou essoufflement extrêmes ;
· battements cardiaques rapides ou irréguliers.
Elévations de l'ALAT
Au cours d'essais cliniques avec des patients traités pour des infections liées au virus de l'hépatite C (VHC) avec des médicaments contenant de l'ombitasvir / paritaprevir / ritonavir et dasabuvir avec ou sans ribavirine, des élévations des transaminases (ALAT) supérieures à 5 fois la limite supérieure de la normale (LSN) ont été constatées plus fréquemment chez les femmes prenant des médicaments contenant de l'éthinylestradiol, comme les contraceptifs hormonaux combinés (CHC) (voir rubriques Contre-indications et Interactions avec d'autres médicaments et autres formes d'interactions).
Cancers :
Certaines études épidémiologiques suggèrent que les contraceptifs oraux combinés pourraient être associés à une augmentation du risque de cancer du col de l'utérus chez les utilisatrices de COC à long terme (> 5 ans). Il n'est cependant pas établi si ces pathologies sont dues à d'autres facteurs comme le comportement sexuel et le papillomavirus humain (HPV).
Une méta-analyse de 54 études épidémiologiques a conclu qu'il existe une légère augmentation du risque relatif (RR = 1,24) de cancer du sein chez les femmes sous contraception orale combinée. Cette majoration du risque disparaît progressivement au cours des 10 ans qui suivent l'arrêt d'une contraception orale combinée.
Le cancer du sein étant rare chez les femmes de moins de 40 ans, le nombre plus élevé de cancers diagnostiqués chez les utilisatrices habituelles ou nouvelles utilisatrices d'une contraception orale combinée reste faible par rapport au risque global de cancer du sein.
Ces études ne permettent pas d'établir une relation de causalité. Il est possible que, chez les utilisatrices de contraception orale combinée, cette augmentation du risque soit due à un diagnostic plus précoce du cancer du sein, aux effets biologiques de cette contraception ou à l'association des deux. Les cancers du sein diagnostiqués chez les utilisatrices ont tendance à être moins évolués cliniquement par rapport à ceux diagnostiqués chez des femmes n'en ayant jamais utilisé.
Dans de rares cas, des tumeurs bénignes du foie, et dans de plus rares cas encore, des tumeurs malignes du foie ont été rapportées chez des utilisatrices de contraceptifs oraux combinés.
Dans des cas isolés, ces tumeurs ont conduit à des hémorragies intra-abdominales mettant en jeu le pronostic vital. Chez les femmes sous contraceptifs oraux combinés, la survenue de douleurs sévères de la partie supérieure de l'abdomen, d'augmentation du volume du foie ou de signes d'hémorragie intra-abdominale doit faire évoquer une tumeur hépatique.
L'utilisation de contraceptifs oraux combinés plus fortement dosés (50 µg éthinylestradiol) diminue le risque de cancer de l'endomètre et de l'ovaire. Ceci demande à être confirmé avec les contraceptifs oraux combinés plus faiblement dosés.
Autres pathologies :
DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU contient un progestatif qui est un antagoniste de l'aldostérone ayant des propriétés d'épargne potassique. Dans la plupart des cas, aucune augmentation de la kaliémie n'est attendue. Cependant, dans une étude clinique, une augmentation modérée non significative de la kaliémie a été observée chez des patientes présentant une insuffisance rénale légère à modérée lors de la prise concomitante de drospirénone et de médicaments épargneurs de potassium. De ce fait, il est recommandé de vérifier la kaliémie lors du premier cycle du traitement chez les patientes présentant une insuffisance rénale pour lesquelles la kaliémie est située dans la limite supérieure à la normale avant traitement, en particulier en cas de prise associée de médicaments épargneurs de potassium (voir également rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Chez les femmes atteintes d'hypertriglycéridémie ou ayant des antécédents familiaux d'hypertriglycéridémie, un risque accru de pancréatite peut survenir en cas d'utilisation d'une contraception orale combinée.
Une augmentation modérée de la pression artérielle a été observée chez de nombreuses femmes sous contraception orale combinée : rarement cliniquement significative. Une interruption immédiate de la contraception orale combinée n'est justifiée que dans ces rares cas.
La persistance de chiffres tensionnels élevés ou le non contrôle des chiffres tensionnels par un traitement antihypertenseur chez une femme hypertendue prenant une contraception orale combinée doit faire interrompre celle-ci.
Cette contraception pourra éventuellement être reprise après normalisation des chiffres tensionnels par un traitement antihypertenseur.
La survenue ou l'aggravation des pathologies suivantes a été observée au cours de la grossesse ou chez des femmes prenant des contraceptifs oraux combinés, bien que la responsabilité des estroprogestatifs n'ait pu être établie : ictère et/ou prurit dû à une cholestase, lithiase biliaire, porphyrie, lupus érythémateux disséminé, syndrome hémolytico-urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose.
Chez les femmes présentant un angioedème héréditaire, les estrogènes exogènes peuvent induire ou aggraver des symptômes d'angioedème.
La survenue d'anomalies hépatiques aiguës ou chroniques peut nécessiter l'arrêt des contraceptifs jusqu'à la normalisation des paramètres hépatiques.
La récidive d'un ictère cholestatique et/ou d'un prurit liés à une cholestase survenue au cours d'une grossesse précédente ou de la prise antérieure d'hormones stéroïdiennes doit faire arrêter les contraceptifs oraux combinés.
Les contraceptifs oraux combinés peuvent avoir un effet sur la résistance périphérique à l'insuline et la tolérance au glucose ; il n'est cependant pas obligatoire de modifier le traitement chez des diabétiques utilisant une contraception orale combinée faiblement dosée (contenant moins de 0,05 mg d'éthinylestradiol). Les femmes diabétiques doivent cependant être étroitement surveillées, en particulier lors de l'instauration d'une contraception orale combinée.
Des cas d'aggravations d'épilepsie, de maladie de Crohn et de rectocolite hémorragique ont été observés sous contraceptifs oraux combinés.
Un chloasma peut survenir occasionnellement, en particulier chez les femmes ayant des antécédents de chloasma gravidique. Les femmes ayant une prédisposition au chloasma sous contraceptifs oraux combinés doivent éviter de s'exposer au soleil ou aux rayons ultra-violets.
L'état dépressif et la dépression sont des effets indésirables bien connus liés à l'utilisation de contraceptifs hormonaux (voir rubrique Effets indésirables). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur médecin en cas de changements d'humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Consultation/examen médical :
Avant l'instauration ou la reprise d'un traitement par DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d'une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l'esprit les contre-indications (voir rubrique Contre-indications) et les mises en garde (voir rubrique Mises en garde et précautions d'emploi). Il est important d'attirer l'attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il doit également être indiqué aux patientes de lire attentivement la notice et de suivre les conseils fournis. La fréquence et la nature des examens doivent être définies sur la base des recommandations en vigueur et adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l'infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
Diminution de l'efficacité :
L'efficacité d'une COC peut être diminuée en cas d'oubli de comprimés (voir rubrique Posologie et mode d'administration), de troubles gastro-intestinaux (voir rubrique Posologie et mode d'administration) durant la prise de comprimé actif ou de prise concomitante de certains traitements (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Troubles du cycle :
Des saignements irréguliers (« spottings » ou métrorragies) peuvent survenir avec tous les contraceptifs oraux combinés, en particulier au cours des premiers mois. Ces saignements irréguliers seront considérés comme significatifs uniquement s'ils persistent après environ 3 cycles.
Si les saignements irréguliers persistent ou surviennent après des cycles réguliers, une recherche étiologique non hormonale doit alors être effectuée ; des examens diagnostiques appropriés doivent être pratiqués afin d'exclure une tumeur maligne ou une grossesse. Ces examens peuvent comporter un curetage.
Chez certaines femmes, les hémorragies de privation peuvent ne pas survenir durant la prise des comprimés placebos. Si la contraception orale combinée a été suivie telle que décrite dans la rubrique Posologie et mode d'administration, il est peu probable que la femme soit enceinte. Cependant, si la contraception orale combinée n'a pas été suivie correctement avant l'absence de la première hémorragie de privation ou si deux hémorragies de privation successives ne se produisent pas, il convient de s'assurer de l'absence de grossesse avant de poursuivre cette contraception.
DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU 3 mg/0,02 mg, comprimé pelliculé contient du lactose et du sodium.
Chaque comprimé rose de ce médicament contient 44 mg de lactose et chaque comprimé blanc contient 89,5 mg de lactose.
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol de sodium par comprimé (23 mg), c'est à dire essentiellement « sans sodium ».
Précautions d'emploi
Obésité (IMC > = 30 kg/m²)
Antécédent familial thrombo-embolique
Cancer
Lupus érythémateux disséminé
Syndrome hémolytico-urémique
Maladie de Crohn
Rectocolite hémorragique
Drépanocytose
Femme de plus de 35 ans
Tabagisme
Hypertension artérielle
Migraine
Diabète
Hyperhomocystéinémie
Valvulopathie cardiaque
Fibrillation auriculaire
Dyslipoprotéinémie
Douleur de l'hypochondre droit
Augmentation du volume du foie
Hémorragie intra-abdominale
Insuffisance rénale légère à modérée
Hypertriglycéridémie
Antécédent familial d'hypertriglycéridémie
Hypertension artérielle non contrôlée
Ictère cholestatique
Prurit de cholestase
Lithiase biliaire
Porphyrie
Chorée de Sydenham
Herpès gravidique
Otosclérose
Angio-oedème héréditaire
Anomalie hépatique (tests fonctionnels)
Antécédent d'ictère cholestatique de la grossesse
Dépression
Epilepsie
Changement d'humeur
Symptôme dépressif
Antécédent de chloasma gravidique
Vomissement
Diarrhée
Aptitude à conduire
Aucune étude sur les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'a été réalisée.
Il n'a pas été observé d'effet sur l'aptitude à conduire ou à utiliser des machines chez les utilisatrices de contraceptifs oraux.
Interaction avec d'autre médicaments
NB: l'information relative à la prescription des médicaments associés doit être consultée pour identifier toute interaction éventuelle.
· Effets d'autres médicaments sur DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU 3 mg/0,02 mg, comprimé pelliculé :
Des interactions peuvent se produire avec des médicaments inducteurs des enzymes hépatiques, ce qui peut induire une augmentation de la clairance des hormones sexuelles et pouvant entraîner des métrorragies et/ou conduire à l'échec de la contraception.
Conduite à tenir L'induction enzymatique peut déjà s'observer au bout de quelques jours de traitement. L'induction enzymatique maximale est généralement observée en quelques semaines. Après l'arrêt du traitement, l'induction enzymatique peut persister environ 4 semaines.
Courte durée de traitement
Les femmes prenant un traitement avec des médicaments inducteurs enzymatiques doivent utiliser temporairement une méthode contraceptive mécanique ou une autre méthode de contraception, en plus de leur contraception orale. La méthode contraceptive mécanique doit être utilisée pendant toute la durée du traitement concomitant et pendant 28 jours qui suivent l'arrêt du traitement. Si l'administration du traitement concomitant va au-delà des comprimés actifs de la plaquette du contraceptif oral en cours, les comprimés placebos doivent être jetés et la plaquette suivante commencée immédiatement.
Traitement long terme
Chez les femmes prenant un traitement à long terme par des substances actives ayant une action inductrice sur les enzymes hépatiques, une autre méthode de contraception fiable, non hormonale est recommandée.
Les interactions suivantes ont été rapportées dans la littérature :
· Médicaments augmentant la clairance des contraceptifs oraux combinés (efficacité diminuée des contraceptifs oraux combinés par induction enzymatique) :
Barbituriques, bosentan, carbamazepine, phénytoïne, primidone, rifampicine et les médicaments contre le VIH (par exemple ritonavir, névirapine, efavirenz) et aussi de façon possible avec felbamate, griséofulvine, oxcarbazépine, topiramate et les préparations contenant du millepertuis (Hypericum perforatum).
· Médicaments ayant un effet variable sur la clairance des contraceptifs oraux combinés :
En cas de co-administration avec les contraceptifs oraux combinés, de nombreuses associations d'inhibiteur de protéase VIH et d'inhibiteur non nucléosides de la transcriptase inverse, incluant les associations des inhibiteurs du VHC peuvent augmenter ou diminuer les concentrations plasmatiques des oestrogènes et des progestatifs. L'effet de ces modifications peut être cliniquement significatif dans certains cas.
Par conséquent, les informations de prescription de médicaments contre le VIH/VHC doivent être consultées pour identifier des interactions potentielles et les recommandations correspondantes. En cas de doute, une méthode de contraception mécanique doit être utilisée par les femmes sous traitement avec un inhibiteur non nucléoside de la transcriptase inverse ou un inhibiteur de la protéase.
· Médicaments diminuant la clairance des contraceptifs oraux combinés (inhibiteurs enzymatiques) :
La pertinence clinique des interactions potentielles avec les inhibiteurs enzymatiques reste inconnue.
L'administration concomitante d'inhibiteurs puissants du CYP3A4 peut augmenter les concentrations plasmatiques de l'oestrogène ou du progestatif ou des deux.
Dans une étude à doses multiples avec une association drospirénone (3 mg/jour) / éthinylestradiol (0,02 mg/jour), la co-administration de kétoconazole, puissant inhibiteur du CYP3A4, pendant 10 jours a augmenté l'ASC (0-24h) de drospirénone et d'éthinylestradiol de 2,7 fois et de 1,4 fois respectivement.
Il a été démontré que des doses d'étoricoxib de 60 à 120 mg/jour augmentent les concentrations plasmatiques de l'éthinylestradiol de 1,4 à 1,6 fois respectivement, lorsqu'elles sont prises en association avec un contraceptif hormonal combiné contenant 0,035 mg d'éthinylestradiol.
· Effets de DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU 3 mg/0,02 mg, comprimé pelliculé sur d'autres médicaments :
Les contraceptifs oraux peuvent modifier le métabolisme de certaines autres substances actives. Les concentrations plasmatiques et tissulaires peuvent donc être soit augmentées (ex: ciclosporine) ou diminuées (ex: lamotrigine).
Chez des femmes volontaires, des études d'interaction in vivo réalisées avec l'oméprazole, la simvastatine et le midazolam comme marqueur, ont montré qu'une interaction cliniquement pertinente de la drospirérone à des doses de 3 mg avec le métabolisme du cytochrome P450 d'autres médicaments était peu probable.
Les données cliniques suggèrent que l'éthinylestradiol inhibe la clairance des substrats du CYP1A2 conduisant à une augmentation faible (par exemple, la théophylline) ou modérée (par exemple, la tizanidine) de leur concentration plasmatique.
Interactions pharmacodynamiques
L'utilisation concomitante de médicaments contenant de l'ombitasvir / paritaprevir / ritonavir et dasabuvir, avec ou sans ribavirine peut augmenter le risque d'élévation des transaminases ALAT (voir rubriques Contre-indications et Mises en garde et précautions d'emploi).
Par conséquent, les utilisatrices de DROSPIRENONE / ETHINYLESTRADIOL MYLAN CONTINU doivent changer leur méthode de contraception (par exemple, une contraception à base de progestatif seul ou des méthodes non hormonales) avant de commencer le traitement avec cette association de médicaments. DROSPIRENONE / ETHINYLESTRADIOL MYLAN CONTINU peut être redémarré 2 semaines après la fin du traitement avec cette association de médicaments.
· Autres formes d'interactions :
Chez les patientes ayant une fonction rénale normale, l'association de drospirénone avec un IEC ou un AINS n'a pas montré d'effet significatif sur la kaliémie. Néanmoins, l'utilisation de DROSPIRENONE/ETHINYLESTRADIOL MYLAN CONTINU 3 mg/0,02 mg, comprimé pelliculé en association avec les antagonistes de l'aldostérone ou des diurétiques épargneurs de potassium n'a pas été étudiée. Dans ce cas, un dosage de la kaliémie pendant le premier cycle de traitement est recommandé (voir également la rubrique Mises en garde et précautions d'emploi).
· Examens biologiques :
L'utilisation de contraceptifs hormonaux peut modifier les résultats de certains examens biologiques tels que : les tests fonctionnels hépatiques, thyroïdiens, surrénaliens et rénaux, le taux plasmatique des protéines (porteuses) comme la corticosteroid-binding globulin (CBG) et des fractions lipidiques/lipoprotéiniques, les paramètres du métabolisme glucidique, les paramètres de la coagulation et de la fibrinolyse. Les modifications restent en général dans les limites de la normale. En raison de sa légère activité anti-minéralocorticoïde, la drospirénone accroît l'activité rénine plasmatique et l'aldostéronémie.
Informations complémentaires pour DROSPIRENONE/ETHINYL MYLAN CON 3 mg/0,02 mg cp
Documents associés
Q/R « Vous et votre traitement en cas de vague de chaleur »
Télécharger le documentMise au point sur le bon usage des médicaments en cas de vague de chaleur
Télécharger le documentConservation des médicaments en cas de vague de chaleur
Télécharger le documentevolution de l'utilisation en France des conatrceptifs oraux combinés COC de janvier 2013 à décembre 2015
Télécharger le documentImpact de la modification récente des méthodes de contraception en France sur la survenue d'embolies pulmonaires chez les femmes de 15 à 49 ans
Télécharger le documentEvolution de l 'utilisation en France des Contraceptifs Oraux Combinés (COC) et autres contraceptifs de janvier 2013 à avril 2014
Télécharger le documentContraceptifs hormonaux combinés : rester conscient des différences entre les spécialités face au risque thromboembolique, de l'importance des facteurs de risque individuels, et être attentif aux manifestations cliniques
Télécharger le documentListe des spécialités concernées par la réévaluation européenne des contraceptifs hormonaux combinés
Télécharger le documentDOCUMENT D'AIDE A LA PRESCRIPTION CONTRACEPTIFS HORMONAUX COMBINÉS
Télécharger le documentPoint sur l'évolution de l'utilisation des contraceptifs depuis 1 an et sur les actions de sécurisation mises en place
Télécharger le documentVOUS et ... Vos contraceptifs oestroprogestatifs
Télécharger le documentContraceptifs hormonaux combinés (pilules, anneau vaginal et patch) : Position finale du Comité des médicaments à usage humain (CHMP) - Point d'information
Télécharger le documentMédicaments contenant le facteur VIII octocog alpha, médicaments contenant de l'hydroxyéthylamidon, médicaments contenant du valproate, les contraceptifs hormonaux combinés, cabazitaxel (Jevatana) – Retour d'information sur le PRAC
Télécharger le documentL'ANSM publie un nouveau point sur l'évolution de l'utilisation des contraceptifs sur 9 mois
Télécharger le documentRetour d'information sur le PRAC
Télécharger le documentPlan d'actions sur les contraceptifs oraux combinés - point de situation à juin 2013 - Communiqué
Télécharger le documentPoint presse « COC » du 26 juin 2013
Télécharger le documentQuestions – Réponses pilule contraceptive
Télécharger le documentEvolution de l'utilisation en France des Contraceptifs Oraux Combinés (COC) et autres contraceptifs de décembre 2012 à mai 2013
Télécharger le documentNouveau point sur l'évolution récente de l'utilisation des contraceptifs en France - Communiqué
Télécharger le documentL'ANSM publie un nouveau point sur l'évolution de l'utilisation des pilules estroprogestatives - Communiqué
Télécharger le documentPoint d'information sur les dossiers discutés en commission de suivi du rapport bénéfice/risque des produits de santé - Séance du mardi 19 mars 2013
Télécharger le documentRisque thromboembolique veineux attribuable aux contraceptifs oraux combinés (COC) et évolution de leur utilisation : résultats des études de l'ANSM
Télécharger le documentL'Agence européenne ouvre de nouveaux chantiers de réévaluation du bénéfice/risque de médicaments
Télécharger le documentActualisation des données sur les contraceptifs oraux combinés (COC)
Télécharger le documentPilules de 3ème et 4ème générations : COMMUNIQUE DE PRESSE
Télécharger le documentContraceptifs oraux estroprogestatifs : préférez les « pilules » de 1re ou 2e génération - BON USAGE DU MÉDICAMENT
Télécharger le documentCOC et risque de thrombose veineuse
Télécharger le documentCONTRACEPTIFS ORAUX COMMERCIALISES EN FRANCE AU 1ER SEPTEMBRE 2012
Télécharger le documentContraceptifs oraux combinés1 et risque de thrombose veineuse : prescription des pilules de 2e génération contenant du lévonorgestrel en première intention
Télécharger le documentLes contraceptifs oraux combinés (appelés le plus souvent « pilules »). Questions/Réponses
Télécharger le documentContraceptifs oraux estroprogestatifs et risque de thrombose veineuse - Point d information
Télécharger le documentCLASSIFICATION DES CONTRACEPTIFS ORAUX
Télécharger le documentExcipients
Comprimé actif (rose) : Noyau : Lactose monohydraté, Amidon de maïs, Povidone, Croscarmellose de sodium, Polysorbate 80, Magnésium stéarate, Pelliculage : Polyvinylique alcool, Titane dioxyde, Macrogol 3350, Talc, Fer oxyde, Fer oxyde, Fer oxyde, Comprimé placebo (blanc) : Noyau : Lactose, Povidone, Magnésium stéarate, Pelliculage : Polyvinylique alcool, Titane dioxyde, Macrogol 3350, Talc
Exploitant / Distributeur
MYLAN
117 allée des Parcs
69800
SAINT PRIEST
Code UCD7 : 9394093
Code UCD13 : 3400893940938
Code CIS : 68727159
T2A médicament : Non
Laboratoire titulaire AMM : MYLAN
Laboratoire exploitant : MYLAN
Prix vente TTC : Non communiqué
Taux de TVA : 10%
TFR (Tarif Forfaitaire de Responsabilité) : Non
Base de remboursement : 0€
Taux SS : 0%
Agréments collectivités : Non
Code acte pharmacie : PHN
Date AMM : 19/09/2012
Rectificatif AMM : 19/05/2021
Marque : ETHINYLESTRADIOL DROSPIRENONE
Gamme : Sans gamme
Code GTIN13 : 3400921905137
Référence LPPR : Aucune
Equivalences strictes
DROSPIRENONE/ETHINYLESTRADIOL VIATRIS CONTINU 3 mg/0,02 mg, comprimé pelliculé, boîte de 3 plaquettes thermoformées de 28 comprimés pelliculés (21 roses + 7 blancs)

